- TOP
- >
- アステラスが経口アンドロゲン受容体阻害剤エンザルタミドを米国で追加適応申請
2014年3月21日 18:00
化学療法施行歴のない転移性去勢抵抗性前立腺がんの追加適応症に向けて
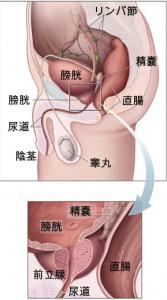
アステラス製薬株式会社(以下、アステラス製薬)は3月19日、米国メディベーション社と共同で開発・商業化を進めている経口アンドロゲン受容体阻害剤エンザルタミドについて、米国食品医薬品局(FDA)に医薬品承認事項変更申請を提出したことを発表した。(wikiメディアより引用)
今回の申請は、化学療法施行歴のない転移性去勢抵抗性前立腺がんの追加適応症に関する追加適応申請となる。エンザルタミドは現在米国においてドセタキセルによる化学療法施行歴を有する転移性去勢抵抗性前立腺がんの治療薬として承認を取得している。
化学療法施行歴のない転移性去勢抵抗性前立腺がん患者1,700名以上を対象に、プラセボ対照試験である第3相PREVAIL試験を実施し、その結果に基づき今回の申請に至った。
転移性前立腺がん治療に新たな選択肢を
アステラス製薬はがん領域においてグローバル・カテゴリー・リーダーを目指しており、今回の申請は重要なステップだと位置づけている。今後はエンザルタミドの追加適応申請により、化学療法施行歴のない転移性前立腺がんにも新たな治療選択肢を提供できることを期待するとしている。(伊藤海)
経口アンドロゲン受容体阻害剤エンザルタミド 米国での追加適応申請に関するお知らせ
http://www.astellas.com/jp/corporate/news/
-->
リファイドニュース新着
記事検索
アクセスランキング トップ10
お問い合わせ