- TOP
- >
- 生体内蛋白の酸化還元状態を可視化!着脱可能な修飾化合物を実用化
2014年12月12日 13:00
システイン
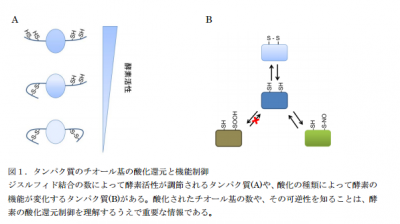
タンパク質はアミノ酸が結合してできています。アミノ酸のひとつシステインが側鎖にチオール基を持ち、近辺のチオール基と結合することによるジスルフィド結合の形成がタンパク質の立体構造を決める条件のひとつになっています。生体を構成する複数のタンパク質を網羅的に解析するプロテオミクス技術や質量分析の進歩により、タンパク質をアミノ酸レベルで解析することが可能になりましたが、チオール基が少ない場合には検出するまでにはいたっていませんでした。東京工業大学の研究
2014年12月1日、東京工業大学は、DNAをシステインに着脱自在な新規の修飾化合物「DNA-PC マレイミド」を開発したと発表。この化合物は紫外線で切断可能なため、抗体色素法で、生体内のタンパク質の酸化還元状態を可視化することができます。
研究成果はBiochemical and Biophysical Research Communicationsのオンライン版に11月28日から公開されています。
今後の展開
タンパク質は酸化還元状態(レドックス状態)の変化によって、機能を発揮したり、機能を停止したりします。そのため、タンパク質の機能調節作用を知るためにはタンパク質がどの状態にあるかを知ることが大切。この研究手法をレドックス・プロテオミクスと呼びます。今回の研究はレドックス・プロテオミクスの解析に大きな武器を与えたことになります。
紹介した技術は特許化しており、同仁科学研究所から発売される予定とのこと。
(画像はプレスリリースより)
東京工業大学 プレスリリース
http://www.titech.ac.jp/news/pdf/tokyotechpr_141201_hisabori.pdf
-->
リファイドニュース新着
記事検索
アクセスランキング トップ10
お問い合わせ